| 治験にかかる経費 | 製造販売後調査にかかる経費 |
| 東京科学大学病院治験等経費算定基準 |  令和7年4月1日 改訂(第2版) 令和7年4月1日 改訂(第2版) |
 令和6年10月1日 制定(第1版) 令和6年10月1日 制定(第1版) |
|
| 東京医科歯科大学病院治験等経費算定基準 |  令和4年11月1日 改訂(第8版) 令和4年11月1日 改訂(第8版) |
 令和3年10月1日 改訂(第7版) 令和3年10月1日 改訂(第7版) |
|
 令和2年4月1日 改訂(第6版) 令和2年4月1日 改訂(第6版) |
|
 令和元年12月1日 改訂(第5版) 令和元年12月1日 改訂(第5版) |
|
 平成31年4月1日 改訂(第4版) 平成31年4月1日 改訂(第4版) |
|
 平成29年11月1日 改訂(第3版) 平成29年11月1日 改訂(第3版) |
|
 平成29年1月1日 改訂(第2版) 平成29年1月1日 改訂(第2版) |
|
 平成28年4月1日 制定(第1版) 平成28年4月1日 制定(第1版) |
1.企業治験の実施にかかる経費
(以下の表は2025年3月31日までの経費となります。2025年4月1日以降の経費は算定基準を参照してください。)
| 費用項目 | 算定内訳 | |||
|---|---|---|---|---|
| 直 接 経 費 |
固 定 費 |
① | 実施部門 治験等準備費用 | 1実施計画書あたり 50,000円(税抜) |
| ② | 審査費用 | 1実施計画書あたり 200,000円(税抜) | ||
| ③ | 支援部門 治験等準備費用 | 1実施計画書あたり 200,000円(税抜) | ||
| ④ | 治験薬管理費用 | 1実施計画書あたり 100,000円(税抜) | ||
| 変 動 費 |
⑤ | 治験実施研究費(登録症例) | 6,000円×研究費ポイント数×登録症例数 | |
| ⑥ | 治験実施研究費(観察期脱落症例) | 6,000円×研究費ポイント数(観察期脱落症例)×観察期脱落症例数 | ||
| ⑦ | 治験実施支援費用(登録症例) | 12,500円×契約月数×登録症例数×支援人数 | ||
| ⑧ | 治験実施支援費用(観察期脱落症例) | 25,000円×観察期脱落症例数×支援人数 | ||
| ⑨ | 被験者負担軽減費 | 7,000円×来院回数 | ||
| そ の 他 費 用 |
⑩ | 外部倉庫保管料(基本) | 7,200円×3ケース×希望保管期間 | |
| ⑪ | 外部倉庫保管料(登録症例あたり加算) | 7,200円×1ケース×希望保管期間×登録症例数 | ||
| ⑫ | 旅費 | 本学旅費規程により算出した額 | ||
| ⑬ | 設備・備品費 | 購入予定額(見積額) | ||
| 管 理 費 |
⑭ | 管理費 | 上記①~⑬までの算定費用合計の20% | |
| 間接経費 | 直接経費小計×30% | |||
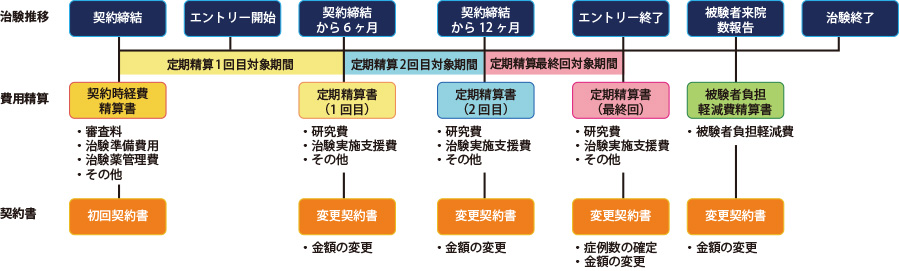
治験・製造販売後臨床試験・製造販売後調査(2025年4月以降にIRB審議された新規調査が対象)における精算(一例)

2.製造販売後調査にかかる経費
(以下の表は2025年3月31日までの経費となります。2025年4月1日以降の経費は算定基準を参照してください。)
| 費用項目 | 算定内訳 | |||
|---|---|---|---|---|
| 直 接 経 費 |
調 査 に 要 す る 経 費 |
① | 報告書作成経費 | 単価※1×報告書数 |
| ② | 症例発表等経費 | 6,000円×ポイント数(製造販売後調査)×0.8 | ||
| ③ | 管理費 | 上記①~②までの算定費用合計の10% | ||
| 間接経費 | 直接経費小計×30% | |||
※1 報告書作成経費の単価
| 調査区分 | 単価 |
|---|---|
| 特定使用成績調査 | 1報告書あたり 30,000円 |
| 使用成績調査(一般使用成績調査、使用成績比較調査) | 1報告書あたり 20,000円 |
| 副作用・感染症報告詳細調査 | 1報告書あたり 20,000円 |
3.経費算定ポイント表
研究費ポイント表はこちらからダウンロードしてください。
| ① | 治験経費ポイント表(医薬品・医療機器・再生医療等製品) |  ダウンロード ダウンロード |
| ② | 製造販売後臨床試験経費ポイント表(医薬品) |  ダウンロード ダウンロード |
| ③ | 製造販売後臨床試験経費ポイント表(医療機器) |  ダウンロード ダウンロード |
| ④ | 製造販売後調査経費ポイント表(医薬品・医療機器・再生医療等製品共通) |  ダウンロード ダウンロード |
| ⑤ | 体外診断用医薬品ポイント表(臨床性能試験) |  ダウンロード ダウンロード |
| ⑥ | 体外診断用医薬品ポイント表(相関試験) |  ダウンロード ダウンロード |
| ⑦ | 臨床研究経費ポイント表 |  ダウンロード ダウンロード |
| ⑧ | 研究支援業務ポイント表 |  ダウンロード ダウンロード |
| 治験にかかる経費 | 製造販売後調査にかかる経費 |
Copyright © All Rights Reserved, Institute of Science Tokyo Hospital, Clinical Research Center