学外申請者の場合
※研究相談および手順確認をご希望ならヘルスサイエンスR&Dセンターまでお問合せください。 |
学内申請者の場合
|

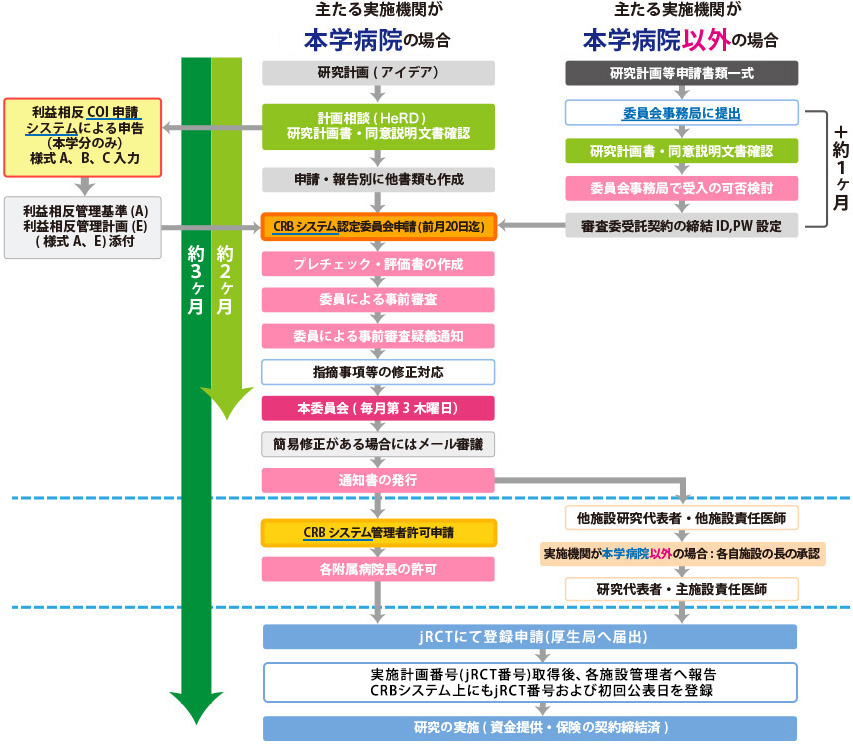
臨床研究法該当研究の申請の流れ
(A) 認定臨床研究審査委員会申請の流れ(B) 実施施設の管理者許可取得の流れ
(C) 必要な情報をjRCT上に入力、審査結果通知書を添付し、申請。
 |
 |
 |
|
 |
| 初回申請 |
・新規審査依頼書(統一書式2)(CRBシステムでは省略) ・実施計画(様式第一) *jRCT入力で作成 ・研究計画書 ・説明文書、同意文書 *jRCT添付 ・研究分担医師リスト(統一書式1) ・疾病等が発生した場合の対応に対する手順書 ・モニタリングに関する手順書 ・利益相反管理基準(様式A) ・利益相反管理計画(様式E) ・医薬品等の概要を記載した書類(添付文書) ・監査に関する手順書 **緑字様式作成時は提出 ・統計解析計画書 ・症例報告書の見本 @CRBシステムに入力・添付し申請 委員会意見書入手後、管理者から通知書受領、赤字様式を印刷、押印し厚生局に送付 |
| 変更申請 |
| 軽微変更 |
| 定期報告 |
| 疾病等報告 |
重大な不適合報告 |
・重大な不適合報告書(統一書式7) @管理者に報告、責任医師は委員会意見 |
他報告 |
・その他の報告(管理者報告で重大でない不適合報告、重大でない疾病、jRCT番号報告等) @管理者に報告、責任医師は委員会意見 |
| 終了報告 |
| 終了届 | @委員会意見受領後1ヵ月以内 jRCTで公表 ・委員会意見書 ・終了届書 (別紙様式1) ・総括報告書の概要・研究計画書・説明文書 ・統計解析計画書(作成時) 厚労大臣提出・管理者(他責任医師)に報告、赤字様式を印刷、押印し厚生局に送付 |
・厚生労働大臣に提出必要な書類(特定のみ)
・実施計画を出力し責任医師捺印後厚生局へ送付
**作成した場合添付
【本学申請者の場合】 意見書入手後、既存システムにて意見書添付し申請
| 省令様式 | 宛先 | 差出 | |
|---|---|---|---|
| 様式第一(39条関係) | 実施計画 | 地方厚生局長 | 責任(代表)医師 |
| 様式第二(41条関係) | 実施計画変更届書 | 地方厚生局長 | 責任(代表)医師 |
| 様式第三(43条関係) | 実施計画軽微変更届書 | 地方厚生局長 | 責任(代表)医師 |
| 様式第四(45条関係) | 特定臨床研究中止届書 | 地方厚生局長 | 責任(代表)医師 |
| 様式第五(65条関係) | 臨床研究審査委員会認定申請書 | 地方厚生局長 | 医療機関代表者 |
| 様式第六(67条関係) | 臨床研究審査委員会認定証 | 医療機関代表者 | 地方厚生局長 |
| 様式第七(69条関係) | 臨床研究審査委員会認定事項変更申請書 | 地方厚生局長 | 医療機関代表者 |
| 様式第八(71条関係) | 臨床研究審査委員会認定事項軽微変更届書 | 地方厚生局長 | 医療機関代表者 |
| 様式第九(73条関係) | 臨床研究審査委員会認定事項変更届書 | 地方厚生局長 | 医療機関代表者 |
| 様式第十(74条関係) | 臨床研究審査委員会認定証書換え交付申請書 | 地方厚生局長 | 医療機関代表者 |
| 様式第十一(75条関係) | 臨床研究審査委員会認定証再交付申請書 | 地方厚生局長 | 医療機関代表者 |
| 様式第十二(76条関係) | 臨床研究審査委員会認定事項更新申請書 | 地方厚生局長 | 医療機関代表者 |
| 様式第十三(77条関係) | 認定臨床研究審査委員会廃止届書 | 地方厚生局長 | 医療機関代表者 |
| 施行通知 別紙様式 | 宛先 | 差出 | |
|---|---|---|---|
| 別紙様式1 | 終了届書 | 地方厚生局長 | 責任(代表)医師 |
| 別紙様式2-1 | 疾病等報告書(医薬品) | PMDA理事長 | 責任(代表)医師 |
| 別紙様式2-2 | 疾病等報告書(医療機器) | PMDA理事長 | 責任(代表)医師 |
| 別紙様式3 | 定期報告書 | 地方厚生局長 | 責任(代表)医師 |
| 特定様式2 | jRCT登録報告書 |
他責任医師⇒管理者 |
代表医師 |